据医药魔方记者了解,君实生物自主研发的重组人源化抗PCSK9单克隆抗体(JS002)已正式获得CFDA核准颁发的药物临床试验批件(批件号:2017L04295)。
君实是国内首家申报PCSK9单抗的生物医药企业,也是第一个拿到PCSK9单抗药物临床批件的医药企业。

国内申报注册的3个PCSK9单抗药物
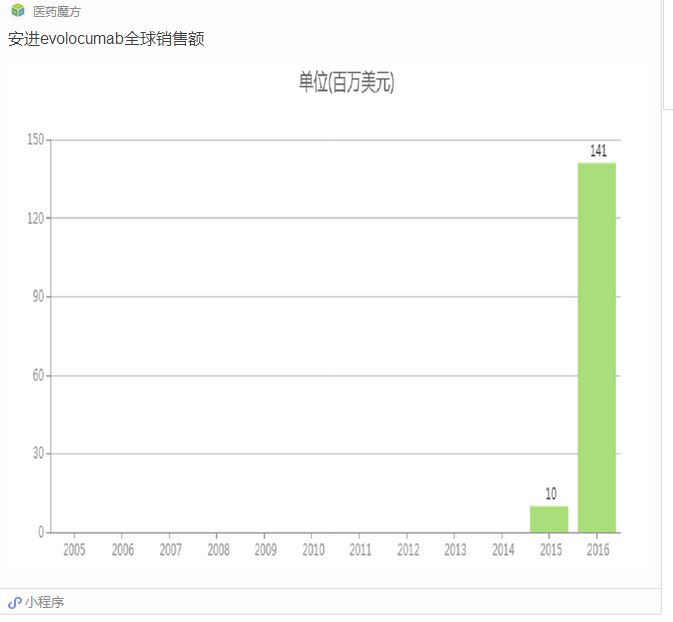
PCSK9(前蛋白转化酶枯草溶菌素9)是他汀类药物之后公认的最有效的降脂靶点。目前全球上市的2个PCSK9单抗药物Repatha(evolocumab,安进)和Praluent(alirocumab,赛诺菲/再生元)在降低LDL-C水平方面均表现出了惊人的效果,可显著降低对他汀类药物不耐受的高胆固醇血症患者的LDL-C水平,并且具有良好的安全性。
最关键的是,已经有evolocumab和bococizumab(辉瑞)两个PCSK9单抗被证实具有心血管获益,可以降低不良心血管事件的风险,同时印证了胆固醇假说。当然,PCSK9单抗也面临因为价格偏高而导致市场吸收低于预期的问题。
JS002是君实自主研发且拥有自主知识产权的新型人源化抗PCSK9单克隆抗体,属于人IgG4κ亚型。JS002在临床前研究中显示了良好的安全性和有效性,与国外已上市的PCSK9单克隆抗体Evolocumab和Alirocumab相比,具有以下特性:
创新性。具有完全不同的抗原识别CDR序列,能识别更多种属的PCSK9,且具有更高的亲和力。
有效性。临床前主要药效学研究以高脂血症恒河猴为模型,结果显示JS002(4,12mg/kg)能显著降低血清LDL-C水平,降幅可达40%-70%,其作用强度和持续时间与Evolocumab文献报道的数据相当。
安全性。在食蟹猴和SD大鼠单次给药(1565mg/kg)的急性毒性研究以及4周重复给药(300mg/kg)毒性研究中均未观测到任何异常和病理学改变。
免疫原性。在食蟹猴单次、多次药动学研究中,各剂量组中均未检测到ADA(抗药抗体),体现了低免疫原性。
JS002已有的临床前数据支持其开展与evolocumab 和alirocumab相同的适应症,包括原发性高胆固醇血症(杂合子家族性和非家族性)和混合型高血脂症、纯合子家族性高胆固醇血症(HoFH),或患有动脉粥样硬化性心血管疾病且需要进一步降低LDL-C水平的患者。
心血管疾病是目前全球第一大疾病死亡原因,而高胆固醇血症引起的血脂异常是导致心血管疾病死亡的重大风险之一。他汀类降血脂药物显示出了良好的临床获益,但仍有近15%的高胆固醇血症患者对他汀类药物不耐受或者家族性高胆固醇血症患者经他汀类药物治疗后LDL-C水平仍难以达标。
目前我国有至少2亿高血脂症患者,但整体的高血脂症防治现状并不乐观。JS002是首个获批开展临床研究的国产PCSK9单抗,可以帮忙满足中国的高胆固醇血症患者的临床需求。
