近日,复星医药发布公告称,公司的控股子公司万邦生化医药及星泰医药收到了CFDA关于同意雷迪帕韦索氟布韦片临床试验的批准。该产品为吉利德的全口服抗丙肝新药,2014年获批上市,2015-2016年全球销售合计超过229亿美元,目前吉利德以及包括复星医药在内的三家国内药企已获批临床,谁将成功抢下中国市场?
上市两年,全球斩获200多亿美元
据悉,目前全球市场上的雷迪帕韦索氟布韦片主要为吉利德科学公司的Harvoni,而该产品尚未进口至中国。
吉利德的Harvoni于2014年10月10日获批上市,是固定剂量的 sofosbuvir(索氟布韦) 和蛋白酶 NS5A 抑制剂ledipasvir(雷迪帕韦)的复方组合。Harvoni 是第一个批准用于治疗基因 1 型丙肝感染,且不需要联合干扰素或利巴韦林的全口服抗丙肝方案。Harvoni既可以单药使用,也可以和其它口服制剂如利巴韦林联合使用。
Harvoni二联方案不含干扰素或利巴韦林,耐受性也有了提高,只需每天一次口服一粒,极大提高了患者的服药便利性。上市后,Harvoni已经成为全口服抗丙肝方案的金标准。
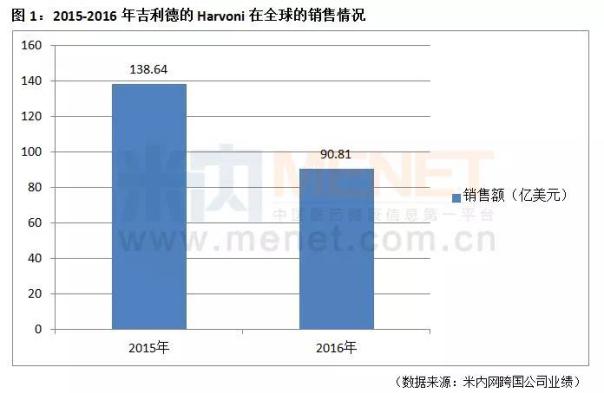
2015年,Harvoni在全球的销售额已经高达138.64亿美元,2016年守住了90亿美元的关口。Harvoni面世后立即成为了全球畅销产品之一,市场潜力一直备受瞩目,有消息称,吉利德已经瞄准了中国市场,雷迪帕韦索氟布韦片进口临床申请已获批准,目前正于中国境内(不包括港澳台地区)开展临床I期和临床III期试验,中国市场有望成为该产品全球销售额爆发式增长的最新战场。
复星医药等三家国内药企已嗅到商机
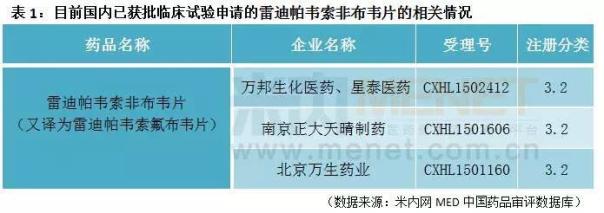
复星医药公告提到,2015 年万邦生化医药、星泰医药就该新药用于治疗成人慢性丙肝(CHC)1 感染向CFDA提交临床试验申请并获受理。该新药为复星医药及其控股子公司自主研发的化学药品,截至2017年6月,复星医药针对该新药已投入研发费用约480万元。
据米内网MED中国药品审评数据库显示,包括复星医药在内,我国已经有三家药企获得了雷迪帕韦索氟布韦片的临床申请。
中国市场成香饽饽,内外夹击谁将吃上大肥肉?
据悉,成人感染丙肝后转化为慢性肝炎的概率却远高于乙肝,可达75~85%,丙肝感染者更易发展成肝硬化和肝癌。由于目前没有针对丙肝的疫苗,对丙肝最好的预防就是治疗。
数据显示,我国所报告的丙肝病例已从2003年的2.1万例上涨至2016年的23万例,呈逐年上升的趋势,国家卫计委疾控局发布的数据显示,中国现有丙肝病毒感染者高达760万。
早前有研究分析称,2013年全球丙肝药物市场规模大约为50亿美元,吉利德的Solvadi在当年获批后把丙肝药物市场带入了新纪元,2014年市场规模突飞猛进至大约180亿美元,随后Harvoni的获批也推动了市场的再一次增长,2015年再度飙升至240亿美元左右。新一代直接抗病毒药物能拉动市场快速扩容,但如此暴力的增速显然不可持续。
目前来看,国外的丙肝市场规模已经接近瓶颈,未来的潜力市场或许只剩下丙肝患者人数占全球大约20%的中国了。

2016年4月,CFDA药品审评中心发布《拟纳入优先审评程序HCV药物注册申请的公示(第二批)》,多个用于治疗丙型肝炎病毒感染适应症的药品注册申请纳入优先审评程序,显示出了政府层面对于我国丙型肝炎病毒治疗的重视。
Harvoni已经用了两年的时间去赢得了全口服抗丙肝方案金标准的口碑。目前,国内外药企正虎视眈眈地注视着中国市场这块肥肉,哪家能顺利成为抢滩者,我们拭目以待。
