作者:April Chen
2017年全球类风湿性关节炎药物市场仍在增长,研发也聚焦到TNF-a抑制剂生物类似物,抗IL-6药物和JAK抑制剂开发上,尤其是在市场份额贡献最大的美国市场。
每月关键事件:
二月
欧洲批准Celltrion的Truxima (Rituxan biosimilar) 用于RA;
欧洲批准Eli Lilly的Olumiant (baricitinib)用于中重度RA 。
三月
欧洲批准Amgen的Amjevita (Humira biosimilar) 用于RA 。
四月
Eli Lilly的Olumiant (baricitinib) 获欧洲NICE通过后,却被美国FDA拒绝,被要求提供更多的关于剂量和风险的临床数据,公司表示将在2018年1月前向美国FDA重新提交上市申请;
FDA批准Samsung Bioepis的Renflexis (Remicade biosimilar) 用于RA。
五月
FDA批准Sanofi/Regeneron的 Kevzara (sarilumab) 用于中重度RA。
六月
欧洲批准Sanofi/Regeneron的Kevzara (sarilumab) 用于中重度RA;
欧洲批准Sandoz的 Erelzi (Enbrel biosimilar) 用于RA;
欧洲批准Sandoz的Rixathon (Rituxan biosimilar)用于RA;
AbbVie的upadacitinib在名为SELECT-NEXT三期试验,15mg 和30mg 用于不应答于常规抗风湿性关节炎疾病缓解化药的中重度RA患者,均达到所有主要终点。
七月
Merck的Renflexis在美国上市,且价格是Remicade价格的75%;
日本批准Eli Lilly的Olumiant (baricitinib) 用于RA;
日本批准Daiichi-Sankyo的Pralia (denosumab) 用于RA 相关的骨侵蚀。
八月
欧洲批准Biogen的Imradli (Humira biosimilar) 用于RA;
FDA批准Beohringer Ingelheim的Cyltezo (Humira biosimilar) 用于RA。
九月
AbbVie的upadacitinib在名为III SELECT-BEYOND三期试验,15mg和30mg用于不应答于常规抗风湿性关节炎疾病缓解生物药的中重度RA患者,均达到所有主要终点;
日本批准Sanofi/Regeneron的Kevzara (sarilumab) 用于中重度RA。
十月
强生在经历7月合作开发方GSK因公司战略调整放弃了sirukumab共同开发权,8月因安全问题考虑FDA拒绝其上市请求的波折后,决定终止sirukumab 用于RA的全球开发。
十一月
欧洲批准Boehringer Ingelheim的Cyltezo(Humira biosimilar) 用于RA。
十二月
AbbVie的upadacitinib在第一个名为III SELECT-MONOTHERAPY三期试验,15mg和30mg对比甲氨蝶呤的中重度RA患者,达到所有主要终点。
三 大 事 件
RA生物类似药竞争激烈,暂时无法撼动修美乐美国市场
从2012年至2016年,修美乐始终位于畅销药品名单前列,2016年全球销售额达到了160亿美元。Humira是继Remicade和Enbrel之后,获得FDA批准的第三种TNF抑制剂类药物。
2009年颁布的“生物制品价格竞争与创新法案”(BPCIA)提供了一套解决围绕生物仿制药与原研药专利纠纷的程序,称之为“专利舞蹈”(Patent Dance)。原研药与生物仿制药制造商之间需要通过至少两轮诉讼或和解过程来完成专利信息的交换。
2016年2月,艾伯维和安进开始进行专利舞蹈,双方通过谈判后确定了10项专利作为第一轮诉讼的专利清单。
这10项专利信息包括以下部分:

剂型专利
延长产品生命期的最关键部分,Abbive在2011-2015年申请了很多剂型专利,就是为了延长2016年过期的核心专利。最关键的是No. 8,916,157,781 和041都是157同族专利,其中781和041是在50mg/ml浓度下的特别组成有机酸和羧酸盐,为更好的皮下注射而改进申请的,但157囊括的范围更广,从20-150mg/ml浓度剂型,所以Amgen即使能绕过前两个,也很难绕过更广的157。
生产技术专利
Amgen作为生物制药先驱者,选择的5个专利都选择的其有丰富经验的生产技术方面,当然Abbive不打无准备的仗,其在修美乐的生产技术方面一直在投入创新。Amgen和Abbive分别选取的945和964专利,虽然都是与细胞系生产阿达木单抗培养基组分有关,但945主要是方法和组分以提高细胞培养的蛋白表达,不包括过程;而964涵盖了检测和控制阿达木单抗培养基组分分批补料过程,而目前能绕过这生产方法只有现在还没有在大批量单抗生产中运用的连续生产技术,这就是使得更难绕过964的专利。Amgen还选取的666,434,645专利都是对945技术上的改进。
使用方法专利
适应症上的挑战, AbbVie选取的693专利是修美乐用于银屑病,在适应症方面的专利非显而易见性,即创新性很容易收到生物类似物的挑战,这是保持疾病市场份额的最关键的专利。
在这场专利舞蹈,最终在2017年9月28日双方达成和解, AbbVie将授予Amgen修美乐在一些国家的非独占性许可,这一许可从2018年10月16日在大部分欧洲国家生效,2023年1月31日在美国生效,比专利过期提早一些。当然Amgen需支付使用费,具体数额未公布。这次和解也为生物类似物挑战首开先河,对两家公司来说也是双赢。
强生的Sirukumab中止开发,给了同为IL-6受体抑制剂赛诺菲/再生元的Kevzara更多机会
在此之前Sirukumab曾被寄予厚望,本有可能成为第一个IL-6受体抑制剂用于RA,但是由于在临床试验中出现多名患者在Sirukumab组的死亡,从FDA告知文件中看,从临床试验结果比较RA生物药的死亡风险。
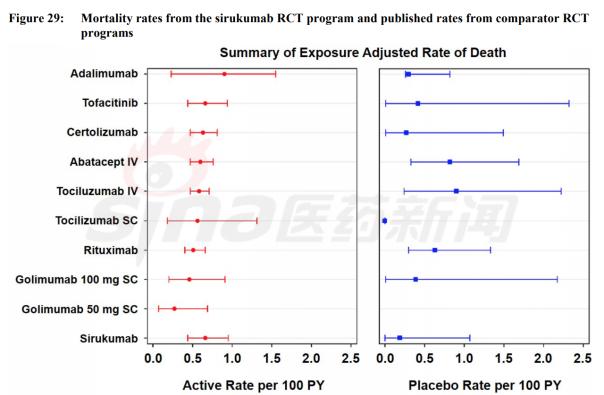
Sirukumab已经有两个抗IL-6抗体上市并无安全性优势,在FDA拒绝批准后强生也放弃了开发,在此之前GSK也在Sirukumab上寄予厚望,眼看就能在北美利润丰厚的市场分得一杯羹的时候退出合作,还是比较少见的。
JAK 抑制剂在RA市场中增长
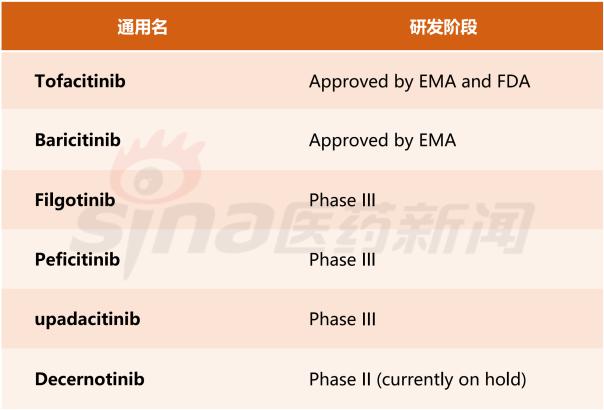
Tofacitinib美国和欧洲化合物专利2020年会过期,但是后面仍有Galapagos的filgotinib, Astellas的peficitinib和AbbVie的upadacitinib准备进入。因为只有约30%的RA患者在生物药治疗后能完全缓解,大部分中重度患者在停药后出现恶化,加上相对于生物制药更方便的服药方式,JAK抑制剂的市场空间的扩大。
但Tofacitnib美国说明书相对于欧洲批准的说明书适用人群较小,将不耐受与一或多种用于不应答于常规抗风湿性关节炎疾病缓解药物限制为只用于患者不应答于甲氨蝶呤治疗。虽然已上市的两个JAK抑制剂已经在与甲氨蝶呤头对头用于早期RA患者中显示优效,但目前美国可能希望看到更多上市后证据以考虑JAK抑制剂是否可以取代甲氨蝶呤一线治疗的地位。
