作者:白小空
截止至2018年6月10日,国家药品监督管理局总共公布了十四批关于药物临床试验数据自查核查注册申请情况的公告,共涉及2455个受理号。其中第一批自查受理号1622个,第二批以后的受理号822个。从总受理号数看,齐鲁制药(含海南)、正大天晴(含南京正大天晴、江苏正大天晴)、石药集团(含欧意、中奇、中诺和恩必普)和浙江华海是妥妥地第一梯队。
第一批进入药物临床试验数据自查核查的药品申请名单属于不知道国家药品监督管理局将对药物进行临床试验数据自查核查的药品申请,第二批以后(含第二批)进入药物临床试验数据自查核查的药品申请名单属于知道临床试验数据自查核查政策后仍新报的注册申请。比较第一批自查受理号数、第二批以后(含第二批)申报自查受理号数和总受理号数,可以从侧面了解2015年以前企业申报和2016年以后企业申报情况。
从总受理号数看,齐鲁制药(含海南)、正大天晴(含南京正大天晴、江苏正大天晴)、石药集团(含欧意、中奇、中诺和恩必普)和浙江华海是妥妥地第一梯队。恒瑞医药(含江苏恒瑞、成都恒瑞和上海恒瑞)和江苏豪森紧跟其后。本次主要介绍第一梯队的情况。
表1 自查受理号数总和排名前列企业

1.齐鲁制药(含海南)
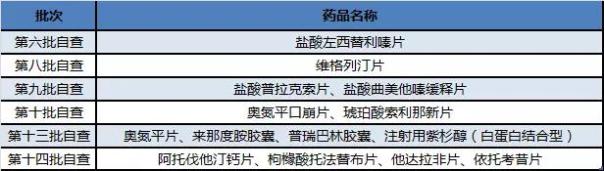
第一批自查涉及10个自查号,其中7个受理号公告撤回,包括阿奇霉素滴眼液、甲磺酸雷沙吉兰片、甲磺酸伊马替尼片、氯法拉滨注射液和盐酸帕洛诺司琼注射液五个产品。缬沙坦氨氯地平片(I)2015年10月已制证完毕但没有见到生产批件,预计已经凉凉了。虽然第一批自查撤回了齐鲁制药还是获批了两个产品富马酸替诺福韦二吡呋酯片和吉非替尼片。第一批自查撤回的甲磺酸伊马替尼片在第十四批中又重新申报了。第三批自查目录的富马酸替诺福韦二吡呋酯片也获批了一新规格。
齐鲁制药第二批自查目录以后申报受理号数有35个,是国内生产企业中最多的,其中第十四批自查就有14个受理号。
齐鲁第二批自查目录以后进入临床自查核查的受理号全部都是仿制药,特别是肿瘤仿制药,如来那度胺胶囊、注射用紫杉醇(白蛋白结合型)。至于其它仿制药的立项原因,预计是根据市场规模决定,例如维格列汀片、阿托伐他汀钙片、他达拉非片。
表2 齐鲁自查核查暂未有注册结果产品(不含撤回重新申报产品)
2.正大天晴(含南京正大天晴、江苏正大天晴)
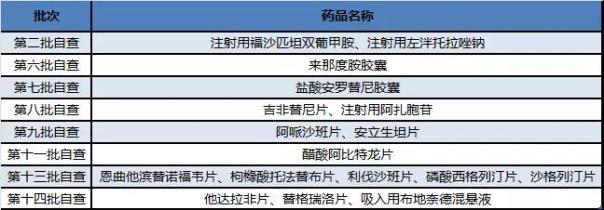
相对于齐鲁制药,正大天晴可谓是全军覆没,16个受理号对应15个产品全部公告撤回,包括吡非尼酮片、丙泊酚中/长链脂肪乳注射液、富马酸替诺福韦二吡呋酯片、拉米夫定片、硫酸氢氯吡格雷片、奈拉滨注射液、羟乙基淀粉(130/0.4)醋酸钠林格注射液、氢溴酸达非那新缓释片、盐酸帕洛诺司琼注射液、注射用多立培南、注射用多黏菌素E甲磺酸钠、注射用头孢替坦二钠和注射用盐酸苯达莫司汀等。
不过,正大天晴可谓是最百折不饶的企业了,项目撤回了还会继续申报,直到获批为止的节奏。最励志的案例当属富马酸替诺福韦二吡呋酯片,第一批自查撤回,第三批自查继续撤回,第五批自查进入药物临床试验数据现场核查计划公告(第10号)后得以获益。
第一批自查目录的注射用多黏菌素E甲磺酸钠还折腾到进入药物临床试验数据现场核查计划公告(第9号)再公告撤回,第十三批自查又见它出现了。
第一批自查目录的注射用盐酸苯达莫司汀撤回后又在第八批自查出现,目前进入药物临床试验数据现场核查计划公告(第13号)。
此外,正大天晴第一批自查名单中的赤苷脉通注射液和环索奈德粉吸入剂在咸达药海遨游数据库显示进度为审批完毕,目前却不见批文,预计也是凶多吉少了。
第二批自查瑞舒伐他汀钙片补充申请已公告撤回。相对应地,正大天晴已上市瑞舒伐他汀钙片目前已获批一致性。
对于正大天晴而言,最值得可喜可贺就是第七批自查名单的1类新药盐酸安罗替尼胶囊在2018年获批上市,其曾进入药物临床试验数据现场核查计划公告(第12号)。
正大天晴第二批自查目录以后进入临床自查核查的受理号数共有29个,排名仅此于齐鲁,正大天晴的申报也是以抗肿瘤为主,但产品线布局明显,包括抗肿瘤药、抗肝病感染药、抗凝药、降糖药。
表3 正大天晴自查核查暂未有注册结果产品(不含撤回重新申报产品)
3.石药集团(含欧意、中奇、中诺、恩必普)
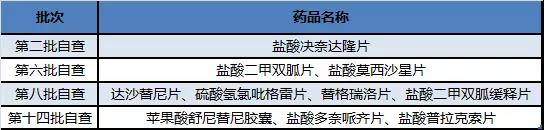
在第一批自查,石药集团(含欧意、中奇、中诺、恩必普)同样全军覆灭,涉及10个产品21个受理号,包括阿卡波糖片、阿莫氨溴片、阿托伐他汀钙分散片、阿托伐他汀钙片、奥拉西坦颗粒、苯磺酸氨氯地平片、非布司他片、非洛地平缓释片、金刚藤软胶囊、氯沙坦钾片、清肝化瘀胶囊、瑞舒伐他汀钙片、缬沙坦胶囊、盐酸伊伐布雷定片、注射用硫酸头孢噻利和注射用盐酸头孢唑兰等。
第二批自查多潘立酮片和第三批自查伊潘立酮片都公告撤回了。
石药在自查核查目录中唯一的斩获是进入第六批自查的注射用紫杉醇(白蛋白结合型),曾进入药物临床试验数据现场核查计划公告(第14号),为该产品的首仿。
表4 石药自查核查暂未有注册结果产品(不含撤回重新申报产品)
4.浙江华海
浙江华海在第一批自查中不仅仅是10个产品21个受理号全军覆灭那么简单,其中一产品还被国家药品监督管理局结论为公告不批准。2015年以来,华海就被批了一些原料药,而制剂回溯上一次获批要到2014年了。
第一批自查被撤回的产品有草酸艾司西酞普兰片、非布司他片、拉莫三嗪片、米格列奈钙片、替米沙坦片、缬沙坦片、缬沙坦氢氯噻嗪片、左乙拉西坦片。其中缬沙坦片在第十一批自查、拉莫三嗪片和左乙拉西坦片在第十三批自查、草酸艾司西酞普兰片和缬沙坦氢氯噻嗪片在第十四批自查重现江湖,这些基本都是双报的产品,不获批似乎对不起国家鼓励国内企业走出去的号召。
第一批自查不予批准的产品有坎地沙坦酯片。第一批自查预计属于自主撤回的产品有坎地沙坦酯氢氯噻嗪片。
华海第二批自查目录以后进入临床自查核查的受理号全部都是仿制药,而且大多数都是双报获批的产品,预计有望加快获批。
表5 华海自查核查暂未有注册结果产品(不含撤回重新申报产品)

*数据来源:咸达药海遨游数据库
原标题:“14批临床数据自查核查情况一览:第一梯队有齐鲁、天晴、石药、华海……”
