作者:Williamxiang
本文以默克公司的Press Release对该公司2018年的新药研发大事予以梳理,其中,每种药物某一适应证只记录其最高动态。
一、新药批准动态
1.FDA/EMA批准的(s)NDA或MAA
(1)帕博利珠单抗新适应证批准动态
①治疗复发型的局部晚期或转移性默克尔细胞癌(MCC)(加速批准)
【批准机构/批准日期】FDA/2018年12月19日。
【作为批准的依据的临床试验】2期CITN-09/KEYNOTE-017,共纳入50名既往未接受过晚期疾病全身性化疗的复发型的局部晚期或转移性MCC患者,主要的有效性结果如下表所示

【适应证基础流行病学特征特征】美国癌症协会的统计数据显示,美国每年大约新增2000例MCC确诊病例。
②涉及到淋巴结的Ⅲ期黑色素瘤患者完全切除术后的辅助治疗
【批准机构/批准日期】EMA/2018年12月17日
【作为批准的依据的临床试验】EORTC1325/KEYNOTE-054试验结果显示,与安慰剂相比,帕博利珠单抗能显著延长受试者的无复发生存期,并将其病情复发或死亡的风险降低44%(HR=0.56;98%CI,0.44-0.72;p<0.0001)。
【适应证基础流行病学特征特征】2018约新增28.7万例以上确诊病例与6万例以上的死亡病例。在欧洲,晚期或转移性黑色素瘤(Ⅳ期)的5年生存率约为5~22%(数据来源:公告)。
【其他】帕博利珠单抗这一新适应证的sNDA于此前的2018年6月25日获FDA受理,其最终决定日是2019年2月19日。
③既往接受过索拉非尼治疗的肝细胞癌(HCC)患者
【批准机构/批准日期】FDA/2018年11月9日(加速批准)
【作为批准的依据的临床试验】KEYNOTE-224试验是一项单组、开放标签的多中心试验,共纳入了104名既往接受索拉非尼治疗但病情进展或不耐受的HCC患者。该项试验主要的有效性结果如下所示。

此外,病情缓解的18名患者中,缓解持续时间(DOR)≥6个月者与≥12月者分别占占89%与56%。
【适应证基础流行病学特征特征】肝细胞癌是最常见的一种肝癌,在所有原发性肝癌病例中占比90%以上。美国癌症协会的数据称,2019年美国将新增4.203万例HCC确诊病例与3.178例死亡病例。
④联合卡铂与紫杉醇(或白蛋白结合型紫杉醇)用于转移性鳞状NSCLC患者的一线治疗
【批准机构/批准日期】FDA/2018年10月30日(加速批准)
【作为批准的依据的临床试验】KEYNOTE-407试验结果证实,帕博利珠单抗联合化疗所带来的生存效益显著优于单独的化疗治疗,具体的有效性结果如下表所示。

⑤联合培美曲塞与铂类化疗用于一线治疗不带有EGFR或ALK基因组肿瘤变异的转移性非鳞状NSCLC患者
【批准机构/批准日期】EMA/2018年9月10日,FDA/2018年8月20日
【作为批准的依据的临床试验】3期KEYNOTE-189试验结果证实,与单独的化疗相比,帕博利珠单抗联合化疗能使所述受试者的死亡风险降低一半(HR=0.49[95%CI,0.38-0.64];p<0.00001)。
⑥难治性的原发性纵膈大B细胞淋巴瘤(PMBCL)
【批准机构/批准日期】FDA/2018年6月13日(加速批准)
【作为批准的依据的临床试验】KEYNOT-170试验是一项多中心、开放标签的单组临床试验,共纳入了53名PMBCL患者。结果显示,帕博利珠单抗治疗后的客观缓解率(ORR)为45%(95%CI:32,60),完全缓解率与部分缓解率依次为11%与34%,而缓解持续时间(DOR)则未达其中位值(1.1+~19.2+月)。
⑦治疗肿瘤表达PD-L1(CPS≥1)的复发型或转移性子宫颈癌患者
【批准机构/批准日期】FDA/2018年6月12日(加速批准)
【作为批准的依据的临床试验】多中心、非随机化、开放标签、多队列试验(KEYNOTE-158)中的E队列数据,该队列共包括77(79%)名肿瘤表达PD-L1、CPS≥1而既往接受过至少一线化疗的子宫颈癌患者,其客观缓解率、完全缓解率与部分缓解率依次为14.3%(95%CI,7.4-24.1)、2.6%与11.7%,11名缓解的受试者中,缓解持续时间(DOR)未达其中值(4.1~18.6+months),而DOR≥6月者占91%。
(2)奥拉帕利新适应证批准动态
①既往采用一线含铂化疗后完全缓解或部分缓解而带有有害的或疑似有害的种系或体BRCA突变的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者的维持治疗
【批准机构/批准日期】FDA/2018年12月19日
【作为批准的依据的临床试验】关键性Ⅲ期SOLO-1试验结果显示,对于既往采用含铂化疗后完全缓解或部分缓解的BRCAm晚期卵巢癌患者而言,奥拉帕利组病情进展或死亡的风险比安慰剂组低70%,而该项试验中奥拉帕利的安全性特征与先前的研究相一致。
【适应证的基础流行病学特征】世界卫生组织(WorldHealthOrganization,WHO)发布的全球癌症统计报告显示,在全球范围内,每年新增的卵巢癌患者约有20万例,并且每年死于该病的患者超过15万人
【其他】该适应证的sNDA于2018年11月12日获FDA受理;奥拉帕利由阿斯利康原研,后者于2017年7月与默克公司达成合成开发的协议。
②维持治疗既往采用含铂化疗后完全缓解或部分缓解的、各种BRCA状态的铂敏感性高级上皮性卵巢癌、输卵管癌或原发性腹膜癌患者
【批准机构/批准日期】EMA/2018年5月8日
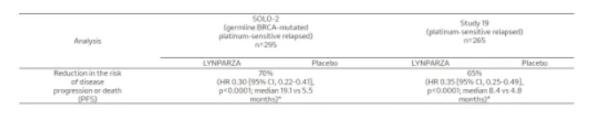
【作为批准的依据的临床试验】作为其依据的SOLO-2与19号研究主要的有效性结果如下表所示。
(3)Doravirine的单方(商品名Pifeltro)与Doravirine/拉米夫定/富马酸替诺福韦酯复方制剂(商品名Delstrigo)
【批准机构/批准日期】EMA/2018年11月28日,FDA/2018年8月30日
【作用机制】Doravirine是一种非核苷类逆转录酶抑制剂(NNRTI)
【适应证】当前与既往均对NNRTI均无耐药性的HIV-1感染者
【作为批准的依据的临床试验】2项关键性的随机化、多中心、双盲、活性对照的3期临床试验DRIVE-AHEAD与DRIVE-FORWARD,分别证实了Delstrigo及Pifeltro与各自活性对照相比的非劣性。整体有效性结果如下表所示。
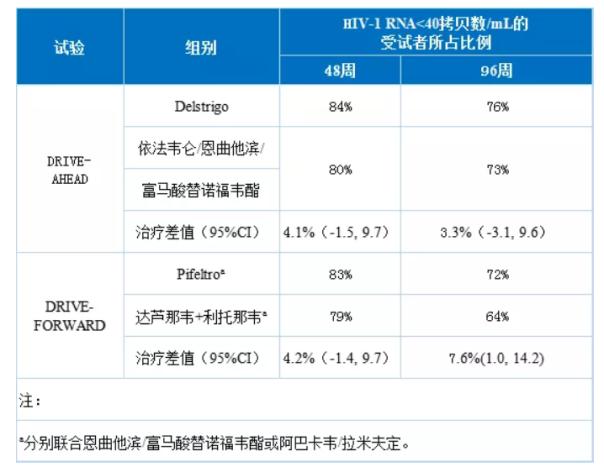
Delstrigo组因为不良反应而提前退出研究的受试者所占比例低于活性对照组,分别为3%与6%。Delstrigo组发生率≥5%的不良反应包括恶心(6%)与头痛(5%)。两项以既往未接受过治疗的HIV-1感染者为研究对象的临床试验汇总分析结果显示,48周内doravirine组因不良反应而提前退出研究的受试者所占比例(2.8%)低于依法韦仑组(6.1%)(治疗差值为-3.4%,p=0.012)。Pifeltro组发生率≥5%的不良反应包括恶心(6%)与头痛(5%)。
(4)仑伐替尼(商品名Lenvima)
【批准机构/批准日期】FDA/2018年8月16日
【作用机制】激酶抑制剂
【适应证】一线治疗不可切除的肝细胞癌患者
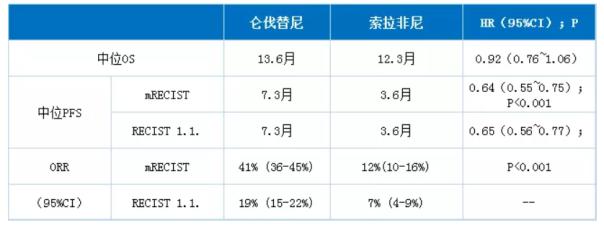
【作为批准的依据的临床试验】3期REFLECT试验结果证实,对于既往未接受过治疗的不可切除性肝细胞癌患者而言,仑伐替尼改善患者总生存期(OS)的效果非劣于索拉非尼,而改善无进展生存期(PFS)与客观缓解率(ORR)的效果则统计学显著性与临床显著性地优于后者,如下表所示。
【其他】仑伐替尼由默克公司与日本卫材公司(原研)合作开发(2018年3月达成协议)。
2.FDA/EMA驳回的(s)NDA或MAA
无
二、新药申报/审评动态
1.新启动的新药申报
(1)启动埃博拉病毒疫苗V920的滚动申请
【日期】2018年11月13日,有望于2019年完成
【适应证】埃博拉病毒
【其他】V920于2016年7月对V920授予的突破性疗法的认证
2.取得进展的新药申报
(1)FDA对帕博利珠单抗新适应证的sBLA予以优先审查
【日期】2018年9月12日
【适应证】一线治疗肿瘤表达PD-L1(TPS≥1%)而且不带有EGFR或ALK基因组肿瘤变异的局部晚期或转移性的鳞状或非鳞状NSCLC患者
【最终决定日】2019年1月11日(然而截止2019年1月14日尚未批准)
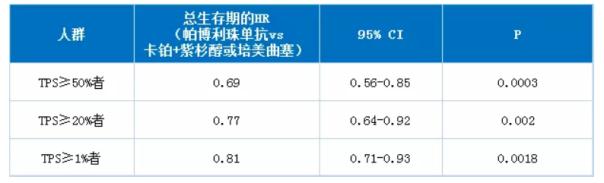
【作为申报的依据的临床试验】3期KEYNOTE-042试验,结果在ASCO2018年年会上公开,整体有效性结果如下所示。
(2)FDA对HPV9-价疫苗新适应证的sBLA予以优先审查
【日期】2018年6月13日
【适应证】用于预防年龄在27~45岁之间的男性与女性发生特定的HPV-相关性癌症与疾病
【最终决定日】2018年10月6日,然而截至2019年1月14日,默克公司却未披露关于该sBLA的进一步进展。
3.受挫的新药申报
无
三、临床试验动态
1.取得进展的临床试验
(1)奥拉帕利上市后临床试验抵达终点
①3期SOLO-3试验
【公布时间】2018年12月20日
【适应证】既往至少采用过两线化疗治疗的BRCA突变型晚期卵巢癌患者
【主要结果/结论】奥拉帕利升高客观缓解率(ORR)与延长无进展生存期(PFS)的效果均显著优于化疗,而且观察到的奥拉帕利安全性特征也与此前的研究一致
【意义】SOLO-3试验是奥拉帕利取得积极结果的第三项临床试验,并也首次证实PARP抑制剂对晚期卵巢癌患者的有效性优于化疗。
②OlympiAD试验
【公布日期】2018年4月15日
【适应证】gBRCA突变型HER2-阴性转移性乳腺癌患者
【主要结果/结论】虽然该项试验的检验效能尚不足以证实显著性差异,奥拉帕利组与化疗组中位总生存期(OS)分别为19.3月与17.1月(HR0.90,95%CI0.66-1.23;p=0.513)。最后的OS数据切入点时,奥拉帕利组与化疗组仍然坚持治疗者所占比例分别为13%与0%。
虽然整体人群分析未能证实奥拉帕利与化疗相比的有效性,然而亚组分组结果显示,对于既往未接受过化疗的受试者而言,奥拉帕利延长期OS的效果显著优于化疗组,两组的中位OS分别为22.6月vs14.7月(HR0.51,95%CI0.29-0.90;nominalp=0.02)。
【意义】默克公司与阿斯利康公司已于2018年4月3日以该项试验为基础向EMA递交了相关MAA。
(2)帕博利珠单抗上市后临床试验取得进展
①KEYNOTE-181
【公布日期】2018年11月14日
【适应证】单独给药用于治疗肿瘤表达PD-L1的晚期食道癌或胃食道交界癌患者
【主要结果/结论】帕博利珠单抗延长受试者的总生存期(OS)的效果显著优于化疗(紫杉醇、多西他赛或伊立替康)(未进一步披露OS数据)。
【意义】使帕博利珠单抗成为首个被证实对此类患者具有生存效益的抗PD-1疗法。
【适应证基础流行病学特征】食道癌是全球发病率排名第7的癌症,在美国,2018年约有1.729万名新确诊病例与1.585万例死亡病例,而全球范围内2018年则有57.2万例新确诊病例与57.2万例死亡病例。
②KEYNOTE-048
【公布日期】2018年10月22日
【适应证】单独给药用于一线治疗肿瘤表达PD-L1(CPS≥20与CPS≥1)的复发型或转移性头颈癌患者,或联合化疗用于一线治疗整体复发型或转移性头颈癌患者。
【主要结果/结论】与标准疗法(西妥昔单抗+卡铂[或顺铂]+氟尿嘧啶)相比,帕博利珠单抗能使CPS≥20与CPS≥1的复发型或转移性头颈癌患者的总生存期分别延长39%(HR0.61[95%CI,0.45-0.83];p=0.0007)与22%(HR0.78[95%CI,0.64-0.96];p=0.0086)。此外,对于不计PD-L1表达状态的复发型或转移性头颈癌患者整体人群而言,与单独的化疗(卡铂或顺铂联合氟尿嘧啶)相比,化疗联合帕博利珠单抗能使患者的总生存期延长23%(HR0.77[95%CI,0.63-0.93];p=0.0034)。
【意义】使帕博利珠单抗成为首个被证实作为一线治疗能为复发型或转移性头颈癌患者带来生存效益的抗PD-1疗法。
【适应证基础流行病学特征】全球范围内,2018年将新增约83.5万例头颈癌确诊病例与43.1万例死亡病例,美国2017年新增病例为6.3万例。
③KEYNOTE-426
【公布日期】2018年10月18日
【适应证】联合辉瑞公司的阿昔替尼用于晚期或转移性肾细胞癌患者的一线治疗
【主要结果/结论】与阿昔替尼单独给药相比,联合疗法能显著改善患者的总生存期(OS)与无进展生存期(PFS),该公告未进一步披露所述试验的具体结果。
【意义】使帕博利珠单抗成为首个被证实联合酪氨酸激酶抑制剂能带来上述效益的抗PD-1疗法。同时,默克公司将以上述试验结果为基础,启动全球范围的相关行政申报工作。
【适应证基础流行病学特征】默克公司声称,肾细胞癌在所有的肾癌病例中占9/10,而其在男性中的发病率是女性的2倍。2018年,全球范围内大约新增403262例肾癌确诊病例与175098例死亡病例,2018年美国肾癌的新增病例与死亡病例分别为63340例与14970例。
④3期KEYNOTE-006与1b期KEYNOTE-001
【公布日期】2018年6月4日
【适应证】晚期黑色素瘤
【主要结果/结论】KEYNOTE-006试验的4年随访数据显示,晚期黑色素瘤患者采用帕博利珠单抗连续治疗两年后的20个月内,病情未进展的患者占86%;KEYNOTE-001试验5年的随访数据则显示,既往未接受过治疗的转移性黑色素癌采用帕博利珠单抗治疗后的5年总生存率为41%。
【意义】帕博利珠单抗单抗治疗黑色素瘤的长期效益得以确证
(3)Doravirine临床试验(DRIVE-SHIFT)抵达非劣性终点
【公布日期】2018年10月4日
【适应证】既往采用其他抗病毒药治疗的HIV-1患者换用doravirine/拉米夫定/富马酸替诺福韦酯复方制剂(商品名Delstrigo)治疗HIV-1
【主要结果/结论】670名既往采用抗病毒方案实现病毒学抑制(不可检出HIV-1RNA)的HIV-1患者分别在第1天(ISG组,N=447)与第24周后(DSG组,N=223)换用Delstrigo。结果显示,ISG组在第48周HIV-1RNA<50拷贝数/mL的受试者所占比例为90.8%(406/447),而DSG组在第24周HIV-1<50拷贝数/mL的受试者所占比例为94.6%(211/223),组间差值为-3.8%(95%CI:-7.9,0.3)。
【意义】扩大了Delstrigo潜在的适用人群。
(4)Ceftolozane上市后临床试验(ASPECT-NP)抵达终点
【公布日期】2018年9月11日
【适应证】院内获得性细菌性肺炎(HABP)或呼吸器相关性细菌性肺炎(VABP)
【主要结果/结论】对于HABP或VABP患者而言,Ceftolozane/他唑巴坦复方(商品名Zerbaxa)治疗后的28天全因性死亡率与临床治愈率均与美罗培南相当(具体数据未披露)。
【意义】充实了Zerbaxa的有效性与安全性证据。
(5)西格列汀上市后比较性临床试验抵达终点
①CompoSIT-I
【公布日期】2018年6月23日。
【适应证】启动胰岛素治疗的2型糖尿病患者
【主要结果/结论】2型糖尿病患者在启动胰岛素治疗时如果继续坚持西格列汀治疗,则其血糖控制效果(HbA1c下降值与实现HbA1C控制目标的受试者所占比例)显著优于停用西格列汀者。具体的,治疗30周后,两组受试者HbA1c分别较基线下降1.88%与1.42%,其差值为0.46%(95%CI:0.34~0.58,P<0.001),而两组实现HbA1c<7.0%的血糖控制目标的受试者者分别占54%与35%,组间差值为18.8%(95%CI:11.6,25.7,p<0.001)。
②CompoSIT-R(西格列汀vs达格列净)
【公布日期】2018年6月23日。
【适应证】伴有轻度肾功能损伤且采用二甲双胍±磺酰脲治疗后血糖控制效果欠佳的2型糖尿病患者
【主要结果/结论】治疗24周后,西格列汀组与达格列净组受试者的HbA1c水平分别较基线值下降0.51%与3.6%,组间差值为1.5%(95%CI:0.04,0.26),并抵达其非劣性终点(P=0.006);两组实现HbA1c<7.0%的受试者分别占43%与27%,组间差值为16%(95%CI:7.7,23.2)。
2.受挫的临床试验
(1)帕博利珠单抗联合Epacadostat治疗黑色素的3期临床试验未达终点
【公布日期】2018年4月6日
【后果】终止试验
【影响】由于该项试验比较了Epacadostat联合帕博利珠单抗治疗与帕博利珠单抗单独给药的有效性与安全性,因此笔者认为,其试验终止不会对帕博利珠单抗的市场前景构成太大的负面影响。
(2)Verubecestat治疗阿尔茨海默氏病的3期临床试验失败
【公布日期】2018年2月13日
【后果】终止试验
【影响】为“成功率极低”的阿尔茨海默氏病的新药研发再次蒙上阴影。
四、附图

