疫苗每年可以预防数百万人死亡,并将某些疾病推向了生存的边缘。然而,事实证明,开发针对多种病毒的有效疫苗即使不是不可能,也具有极大的挑战性。
尽管进行了数十年的研究,但尚未有得到批准的疫苗能够长期预防流感病毒、爱泼斯坦巴尔病毒(EBV)或呼吸道合胞病毒(RSV)。比如,对作为一种引起呼吸道感染的病原体的RSV而言,高风险婴儿每月接受合成抗体注射,以便在短期内保护这些婴儿。
近年来,几组研究人员探索了一种不同的方法:利用免疫系统自身产生抗体的B细胞,并利用CRISPR对它们进行改造,以便在感染的情况下按要求大量表达针对这些难以治疗的病毒的抗体。
在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心和华盛顿大学的研究人员通过这样做,成功地对人类和小鼠B细胞进行基因修饰来表达靶向HIV、EBV、流感病毒和RSV的抗体。他们还证实这些经过基因改造的B细胞在小鼠感染模型中阻止RSV感染。相关研究结果发表在2019年5月17日的Science Immunology期刊上,论文标题为“B cells engineered to express pathogen-specific antibodies protect against infection”。
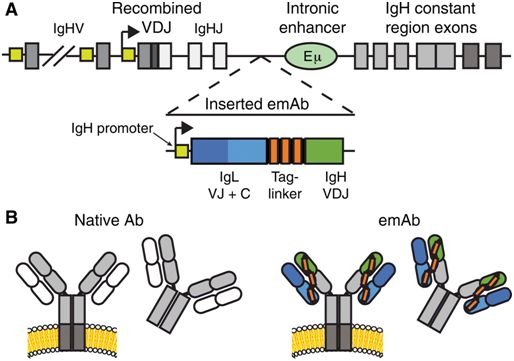
图片来自Science Immunology, 2019, doi:10.1126/sciimmunol.aax0644。
美国明尼苏达大学基因组工程师Branden Moriarity(未参与这项新的研究)说道,“这是一项非常好的研究。这是人们长期以来一直在思考的概念。”
为了对B细胞进行修饰,弗雷德哈钦森癌症研究中心免疫学家Justin Taylor和他的团队探究了在之前研究中经证实有效对抗这四种病毒中的每一种的抗体。他们使用一种常规的CRISPR策略将编码抗体的DNA插入到在原代人B细胞的抗体编码基因上产生的小切口中。
这些研究人员设计了这种插入,使得新抗体蛋白的表达受到这些细胞自身启动子的调节,从而允许这些细胞能够像正常那样在经受病毒抗原触发后产生它们。他们将尽可能多地让这些经过修饰的B细胞分化为分泌抗体的血浆B细胞,这些血浆B细胞在它们的细胞表面上表达这些抗体并分泌它们。
一旦这些研究人员证实这些经过修饰的B细胞中的一个合理比例确实表达这些新抗体,他们就会研究这些细胞是否在小鼠中抵抗病毒感染。他们在小鼠B细胞中重复了这个过程,诱导它们表达靶向RSV的抗体,将成功修饰的B细胞群体灌注到正常的啮齿动物中,然后等待一段时间。
六天后,RSV特异性抗体出现在它们的血清中,但没有出现在对照小鼠中。这些小鼠中的一些动物接受鼻内剂量的RSV注射,这些经过修饰的B细胞成功地抵抗这种病毒。五天之后,这些研究人员几乎没有在血液中含有这些经过修饰的B细胞的小鼠肺部中检测到任何水平的RSV,但是他们在不含有这些B细胞的对照小鼠中发现了高水平的这种病毒。
Taylor说,他认为这些经过修饰的B细胞可能对经历过造血干细胞移植的患者有用。这些患者通常服用了免疫抑制剂,非常容易受到病毒感染。这些患者遭受的RSV感染能够通过诸接受如帕利珠单抗之类的合成抗体注射来阻止,但是必须定期接受这种注射。另一方面,经过改造的B细胞理论上仅需注射一次。
为了研究经过改造的B细胞是否可能在这种情况下提供保护,这些研究人员研究了缺乏T细胞和B细胞的突变小鼠。在他们将这些细胞注入到这些突变小鼠中后,他们吃惊地发现与野生型小鼠相比,这些突变小鼠中的RSV特异性抗体似乎在血液中停留更长时间。事实上,免疫缺陷小鼠在接受这些经过改造的B细胞移植82天后就能够预防RSV感染。Taylor解释道,为何会这样是“我们需要更多探索的东西”。
总的来说,Taylor团队采用的方法类似于近期其他研究所采用的方法,比如发表在eLife期刊上的一项研究(eLife, 2019, doi:10.7554/eLife.42995)和发表在Journal of Experimental Medicine期刊上的一项研究(Journal of Experimental Medicine, 2019, doi:10.1084/jem.20190287),这两者都使用CRISPR来构建表达HIV中和抗体的B细胞。但是不同之处在于,当前的这项新的研究解决了对抗体编码基因进行改造的过程中的一些关键难题。
这是件棘手的事情:首先,抗体是由两个基因合成的---一个基因用于编码抗体的重链,一个基因用于编码抗体的轻链。一旦重链和轻链分别翻译成蛋白,它们就会融合在一起形成最终的抗体。对这些基因进行编辑所面临的挑战在于错配有时可能会发生,从而导致由经过改造的重链与B细胞自身的轻链配对在一起组成的杂合抗体。在某些情况下,这可能会导致自身免疫反应。Taylor解释道,“这种风险很低. . .但是,鉴于几百万个B细胞有数百万个独特的轻链,这个风险不值得冒。”
Taylor团队通过将编码重链和轻链的DNA在物理上连接在一起并将连接后的DNA插入到单个CRISPR切割位点中来解决这个问题。(其他的研究小组已设计出不同的策略来解决这个问题,比如,敲除B细胞自身的轻链编码基因。)
美国西雅图儿童研究所免疫学家Richard James(未参与这项新的研究)评论道,“我认为他们用来将轻链和重链融合在一起的基因改造策略是一个很好的想法,这很不错。”
然而,他补充道,“在实践中,这将是一种昂贵的疗法”,并指出个性化的CAR-T细胞疗法已被认为花费接近50万美元。就目前而言,B细胞疗法必须是个性化的:鉴于这些细胞表达个体特异性的细胞表面抗原,来自一个供者的细胞在不同的受者中会遭受免疫排斥。他补充道,“除非我们能找到构建同种异体B细胞的方法,只有这样才会变得更具成本效益。”
Moriarity同意这一点。他说,“只有当你患者一种你将死于的疾病而且真地没有其他的治疗方法时”,预防性地使用经过改造的B细胞可能只是一种可行的治疗选择。不过,他说,这项新的研究为未来的研究提供了其他的可能性,而且也是最早在小鼠B细胞中对抗体进行改造的研究之一。对于研究B细胞分化和细胞与免疫相关过程的科学家来说,“我认为这将对基础生物学领域做出巨大贡献”。
曾是哈佛大学免疫工程师如今是免疫治疗创业公司STIMIT首席执行官的Michael Goldberg认为这项新的研究是“之前研究的一个很好的延伸”。对他来说,B细胞抗体改造除了能预防病毒感染外,还具有其他优势:比如,具有对血液中抗原浓度作出反应的抗体水平可能可用于治疗诸如类风湿性关节炎之类的疾病,其中类风湿性关节炎通常用中和细胞因子TNFα的抗体加以治疗。
然而,“抗体表达的持续时间需要增加。在这方面,加强我们对移植过程和B细胞培养条件的理解将是重要的。尽管如此,鉴于这些是第一批涉及对经过改造的B细胞进行过继性转移的实验,初步结果令人鼓舞。”
Taylor同意仍有更多的研究工作需要开展。他说,“我们在这项研究中完全忽略的一件事是真正评估我们正在做的事情的安全性,确保没有任何脱靶效应发生,我认为这一直是人们针对CRISPR-Cas9所关心的一个问题。在用于人体治疗之前,我们必须绝对确定它是安全的。”
参考资料:H.F. Moffett et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology, 2019, doi:10.1126/sciimmunol.aax0644.
原标题:Science子刊:经过CRISPR编辑的B细胞产生抗体,对抗难以治疗的病毒
